台湾采购的15万莫德纳新完疫苗近日已抵达,将进行检验封缄;台湾食药署表示,已在5月28日晚间完成首次输入莫德纳新完疫苗冷链查核与样本抽取,将并连夜携回食药署实验室进行检验,若审查文件数据与检验皆合格,可力拼于两周内,也就是6月11日内验毕并核发封缄证明书。
食药署5月28号晚间公布,完成首次输入莫德纳新完疫苗,共15万剂的冷链查核与样品抽取,并连夜携回食药署实验室进行检验,若审查文件数据与检验皆合格,力拚于2周内(6月11日)验毕并核发封缄证明书。但是有网友查询台湾进口新冠疫苗批号3002544、3002615在莫德纳官网都查不到生产日期
食药署表示,输入15万剂新完疫苗共有二批,分别是批号3002544有1.44万剂,效期到11月27日,批号3002615的有13.56万剂,效期则到11月29日,于5月28日晚间自卢森堡空运抵台入库,食药署同步派员赴仓储现场监督拆箱、核对新完疫苗批号、清点数量、查核运送冷链(保存于-25℃至-15℃),并各抽取600剂样品进行新完疫苗异物检查,在-20℃冷冻仓储封存新完疫苗后将样品携回食药署国家实验室。
台湾食药署表示,在实验室将进行外观、鉴别、pH值、纯度、不纯物、RNA含量、RNA包覆率、细菌内毒素、无菌等试验,因食药署日前已收到原厂提供试剂与标准品进行方法测试,若经审查文件数据与检验皆合格,食药署力拼于6月11日前验毕并核发封缄证明书,后续完成此二批14.88万剂封缄后,即可交由疾病管制署进行后续新完疫苗接种作业。
台湾食药署同步派员赴仓储现场监督拆箱、核对新完疫苗批号、清点数量、查核运送冷链(保存于-25℃至-15℃),并各抽取600剂样品进行新完疫苗异物检查。
台湾食药署说,在-20℃冷冻仓储封存新完疫苗后,将样品携回食药署国家实验室,进行外观、鉴别、pH值、纯度、不纯物、RNA含量、RNA包覆率、细菌内毒素、无菌等试验。
因日前台湾已收到原厂提供试剂与标准品进行方法测试,若经审查文件数据与检验皆合格,食药署说明,力拚6月11日前验毕并核发封缄证明书,后续完成此二批共14万8800剂封缄后,即可交由台湾疾病管制署进行后续新完疫苗接种作业。
Moderna COVID-19 疫苗尚未获得美国食品和药物管理局 (FDA) 的批准或许可,但已根据紧急使用授权 (EUA) 获得 FDA 的紧急使用授权,以预防 2019 年冠状病毒病 (COVID- 19) 用于 18 岁及以上的个人。没有 FDA 批准的疫苗可以预防 COVID-19。
Moderna COVID-19 疫苗的 EUA 在 COVID-19 EUA 声明期间有效,证明该产品的紧急使用是合理的,除非声明终止或授权被提前撤销。
如何查找小瓶有效期
要查找任何瓶 Moderna COVID‑19 疫苗的失效日期,请找到印在纸箱和瓶上的批号。在下面的字段中输入批号,然后按“提交”。
莫德纳官网:
You Entered: 3002544
Sorry, that number does not exist.
Check and re-enter the Vaccine Lot Number. If you still receive no result, please call 1‑866‑MODERNA (1‑866‑663‑3762) for assistance. Thank you for using the Moderna Expiration Lookup Tool.
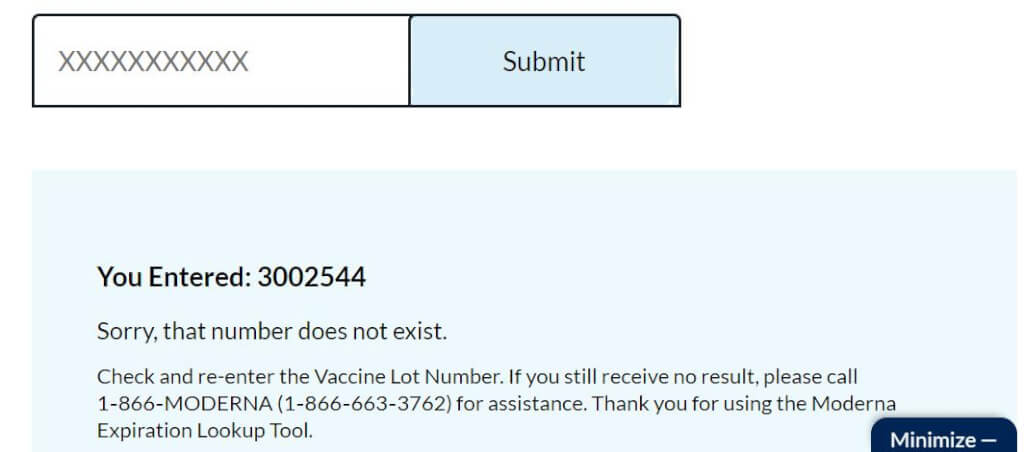
您输入了:3002544
抱歉,该号码不存在。
检查并重新输入疫苗批号。如果仍然没有结果,请致电1-866-MODERNA(1-866-663-3762)寻求帮助。感谢您使用 Moderna 到期查找工具。
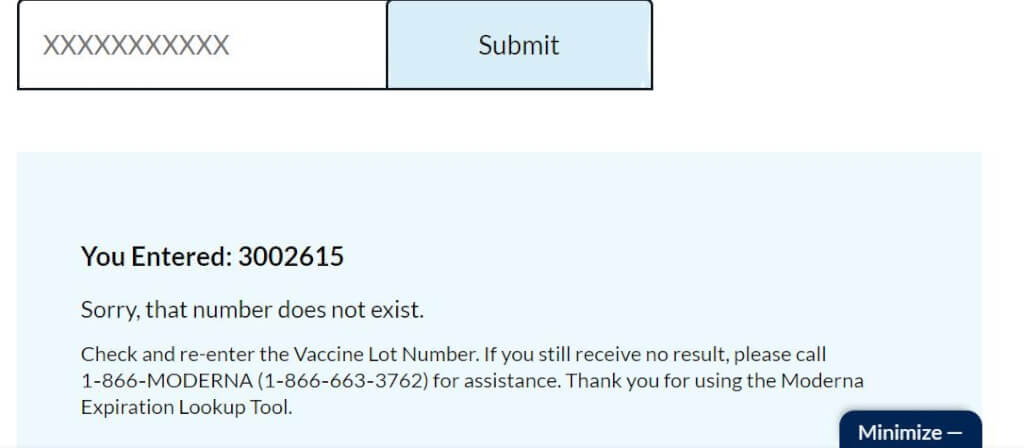
You Entered: 3002615
Sorry, that number does not exist.
Check and re-enter the Vaccine Lot Number. If you still receive no result, please call 1‑866‑MODERNA (1‑866‑663‑3762) for assistance. Thank you for using the Moderna Expiration Lookup Tool.
您输入了:3002615
抱歉,该号码不存在。
检查并重新输入疫苗批号。如果仍然没有结果,请致电1-866-MODERNA(1-866-663-3762)寻求帮助。感谢您使用 Moderna 到期查找工具。
授权使用
Moderna COVID-19 疫苗已根据紧急使用授权 (EUA) 获得授权,可用于主动免疫,以预防 18 岁以下的严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 引起的 2019 年冠状病毒病 (COVID-19)年龄大了。Moderna COVID-19 疫苗正在研究中,未经 FDA 批准。
重要安全信息
禁忌症
不要对已知对 Moderna COVID-19 疫苗的任何成分有严重过敏反应(例如过敏反应)病史的个体使用 Moderna COVID-19 疫苗。
警告和注意事项
急性过敏反应的管理:如果在接种 Moderna COVID-19 疫苗后发生急性过敏反应,则必须立即采取适当的药物治疗来管理立即的过敏反应。根据疾病控制和预防中心指南(https://www.cdc.gov/vaccines/covid-19/clinical-considerations/managing-anaphylaxis.html)。
改变的免疫能力:免疫受损的人,包括接受免疫抑制治疗的人,对Moderna COVID‑19疫苗的反应可能减弱。
疫苗有效性的局限性: Moderna COVID-19 疫苗可能无法保护所有疫苗接种者。
不良反应
在施用 Moderna COVID-19 疫苗后的临床试验中报告的不良反应包括注射部位疼痛、疲劳、头痛、肌痛、关节痛、寒战、恶心/呕吐、腋窝肿胀/压痛、发烧、注射部位肿胀、和注射部位的红斑。
据报道,在临床试验之外的大规模疫苗接种期间,接种 Moderna COVID-19 疫苗后会出现严重的过敏反应,包括过敏反应。
随着 Moderna COVID-19 疫苗的更广泛使用,其他不良反应可能会变得明显,其中一些可能是严重的。
报告不良事件和疫苗管理错误
疫苗接种提供者负责向疫苗不良事件报告系统 (VAERS) 强制报告以下内容:
疫苗接种错误是否与不良事件相关
严重不良事件(与疫苗接种无关)
成人多系统炎症综合征 (MIS) 病例
导致住院或死亡的 COVID-19 病例
通过https://vaers.hhs.gov/reportevent.html在线完成并向 VAERS 提交报告。如需向 VAERS 报告的进一步帮助,请致电1-800-822-7967。报告应在报告的描述部分包含“Moderna COVID-19 Vaccine EUA”字样。
到ModernaTX,公司报告致电1-866-MODERNA(1-866-663-3762)或传真1-866-599-1342或发送电子邮件提供VAERS表格的副本[email protected]。
怀孕和哺乳
向孕妇接种 Moderna COVID-19 疫苗的现有数据不足以告知妊娠期疫苗相关风险。没有数据可用于评估 Moderna COVID-19 疫苗对母乳喂养婴儿或牛奶生产/排泄的影响。
剂量和时间表
Moderna COVID-19 疫苗以一系列两剂(每剂 0.5 毫升)间隔 1 个月的形式肌肉注射给药。
没有关于 Moderna COVID-19 疫苗与其他 COVID-19 疫苗可互换性以完成疫苗接种系列的数据。已接种一剂 Moderna COVID-19 疫苗的个人应接种第二剂 Moderna COVID-19 疫苗以完成疫苗接种系列。
发表回复